2023年6月3日,我校药学院、生物反应器工程国家重点实验室、光遗传学与合成生物学交叉学科研究中心程侠卫/赵玉政/杨弋团队在细胞自噬的调控机制方面取得最新研究进展,在国际学术期刊《Science Advances》发表题为“ULK1-mediated metabolic reprogramming regulates Vps34 lipid kinase activity by its lactylation”的研究文章。

细胞自噬是真核生物中进化保守的、对细胞内物质进行周转的重要过程,是来源于粗面内质网的无核糖体附着区的双层膜包裹部分胞质和细胞内需要降解的细胞器、蛋白质、受损伤的细胞结构等形成自噬体,并与溶酶体融合形成自噬溶酶体,利用溶酶体蛋白酶水解,降解其所包裹的内容物,供细胞重新利用以实现细胞本身的代谢需要和某些细胞器更新的过程。自噬在生理和病理过程中起着重要的作用,包括对代谢应激的适应、蛋白质聚集物和受损细胞器的清除、胚胎着床前发育、衰老、神经退行性疾病、肿瘤的发生发展等。细胞自噬调控及在生理和病理中作用一直是研究的热点。
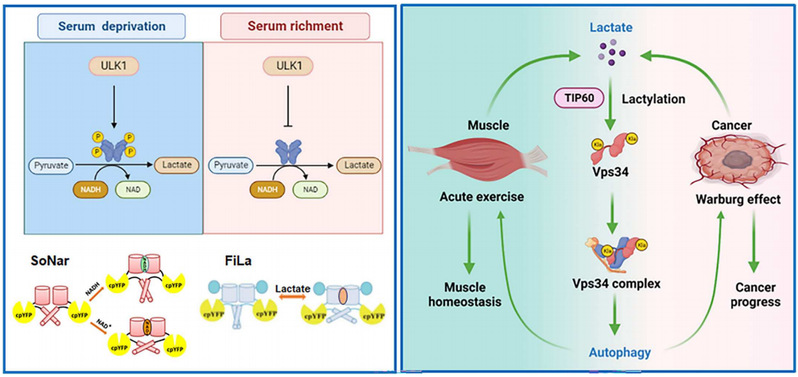
在本研究中,研究团队发现了乳酸调控细胞自噬的新机制。实验结果表明ULK1激酶通过磷酸化乳酸脱氢酶A(LDHA)丝氨酸196位,增强LDHA活性,促进乳酸分泌。乳酸在酰基转移酶KAT5/TIP60的催化下介导III型磷脂酰肌醇激酶(Vps34)赖氨酸356和781位乳酸化修饰。Vps34乳酸化修饰显著促进Vps34复合物亚基的相互作用,提高其激酶活性,进而促进细胞自噬发生和内体-溶酶体降解途径。此外,本研究通过小鼠肌肉运动模型和临床肿瘤样本阐释了Vps34乳酸化对肌肉运动稳态和肿瘤进展的作用。在生理状态下,剧烈运动过程中肌肉产生的乳酸介导Vps34乳酸化,提高肌肉组织细胞自噬水平,维持肌肉组织在运动状态下的稳态。在病理状态下,肿瘤组织有氧糖酵解产生的高水平乳酸作为信号分子,通过调节Vps34乳酸化,提高肿瘤细胞自噬,促进肿瘤进展。
综上所述,该文的研究成果阐明了ULK1磷酸化调节LDHA活性的分子机制,阐明了乳酸介导的Vps34对细胞自噬和内体-溶酶体降解途径的影响,揭示了Vps34乳酸化对肌肉运动稳态和肿瘤进展的影响,整合了糖酵解调控途径和细胞自噬调控途径,显示高等哺乳动物细胞自噬调控的多元化和复杂性。
药学院博士研究生贾梦淑、岳筱、孙伟霞,硕士研究生周千钧,上海交通大学医学院附属胸科医院常城为本文共同第一作者,药学院程侠卫研究员、赵玉政教授、杨弋教授为本文共同通讯作者。该研究得到了国家重点研发计划、国家自然科学基金、上海市细胞代谢光遗传学技术前沿科学研究基地、中国医学科学院细胞代谢监测成像新技术创新单元、生物反应器工程国家重点实验室基金等经费资助。
原文链接:https://www.science.org/doi/10.1126/sciadv.adg4993