Journal of Controlled Release报道我院肿瘤微环境对乳腺癌的发生和转移有着促进作用。开发同时作用于癌细胞和肿瘤微环境重要组成细胞的治疗策略是癌症治疗领域的新突破点。近日我校药学院高峰课题组又有新突破,提出一种将光控基因表达铜绿假单胞菌外毒素靶向递送治疗乳腺癌肺转移的新策略。多靶向多功能纳米粒,可将LightOn光控基因系统质粒精准靶向递送至肿瘤细胞、肿瘤相关成纤维细胞和肿瘤新生血管细胞;在蓝光照射的控制下,该纳米递药系统能够时空可控地表达铜绿假单胞菌外毒素A,起到抑制肿瘤细胞、肿瘤相关成纤维细胞和抗肿瘤新生血管生成的作用;进而下调肿瘤部位相关细胞因子水平,改变肿瘤微环境,最终在精准治疗肿瘤的同时,突破乳腺癌转移难题。多靶向多功能纳米载体的靶向性、肿瘤环境响应释放能力和LightOn系统的时空可控性,赋予了该治疗策略提高疗效和减少毒副作用。相关成果以“Spatiotemporally controlled Pseudomonas exotoxin transgene system combined with multifunctional nanoparticles for breast cancer antimetastatic therapy”为题发表在国际学术期刊《控释杂志》上(J Control Release, 2023, S0168-3659(23): 00507-2.)。
本成果扎根于前期夯实的基础研究,是高峰教授和杨弋教授课题组一系列早期研究成果的成功拓展。前期研究内容包括LightOn光控基因系统的开发(Nat Methods, 2012, 9(3): 266-9.)和结合多功能靶向纳米系统应用与肿瘤治疗(Acta Pharm Sin B, 2020, 10(9): 1741-1753. ; J Control Release, 2020, 319: 1-14. ; Int J Pharm, 2022, 618: 121613-121625 ; J Control Release, 2023, 355: 538-551.)。
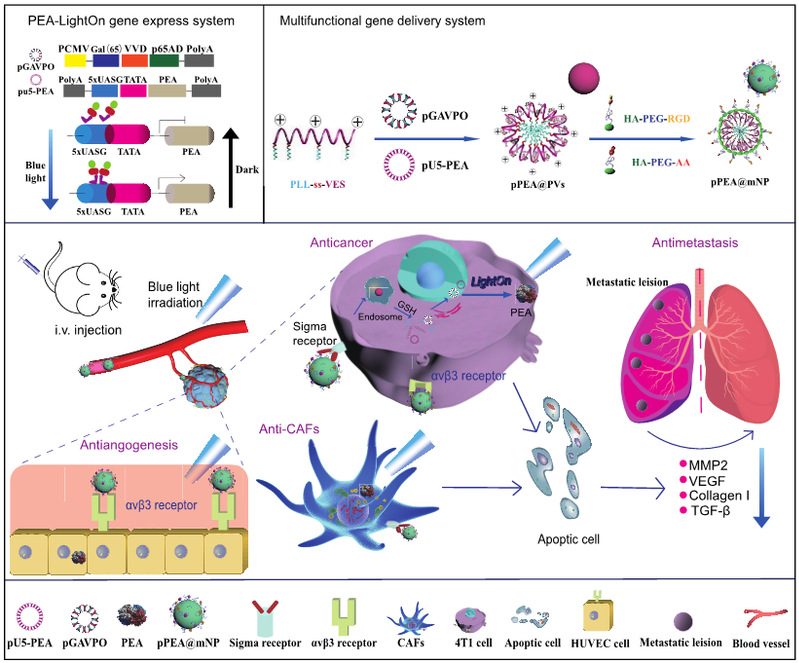
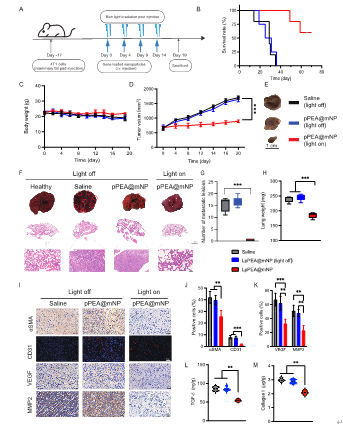
该研究展示了一种时空可控的转基因系统与双靶向多功能纳米递药系统相结合调控肿瘤微环境的治疗方法,具有巨大的肿瘤治疗潜力。
上述工作主要在高峰教授和陈显军教授指导下,由我校程驿博士等人,经由杨弋教授、赵玉政教授、蓝闽波教授和楼开炎副教授的建议和帮助下完成。第一作者为程驿博士,共同通讯作者为陈显军教授和高峰教授。同时,该研究的成功实施,主要依托于上海市细胞代谢光遗传学技术前沿科学研究基地的支持和国家自然科学基金等项目的资助。原文链接:https://doi.org/10.1016/j.jconrel.2023.08.011