10月27日,我校药学院、生物反应器工程国家重点实验室、上海市细胞代谢光遗传学技术前沿科学研究基地赵玉政教授与上海交通大学医学院郑俊克研究员合作在国际权威学术期刊Trends in Cell Biology 发表题为“Regulation of leukemogenesis via redox metabolism”的综述文章,对氧化还原代谢调控白血病发生发展的病理机制以及目前存在的关键问题进行了全面的梳理、总结和展望。

氧化还原代谢是一类重要的生化反应,它既驱动能量和物质代谢,也决定了细胞的氧化还原状态,对细胞存活、增殖、分化等命运至关重要。氧化还原代谢在白血病的发生发展中发挥了重要作用,相比于实体瘤,白血病细胞先天具有在循环-免疫系统中迁移和生存的能力,增强了它们对氧化应激和转移过程中失巢凋亡的抵抗;同时白血病细胞还演化出显著的代谢异质性,以应对骨髓、血液或脾脏组织不同的营养和氧气供给等条件带来的挑战。为了深入研究白血病的氧化还原代谢调控机制,急需创新发展适用于单细胞、在体的代谢监测技术。遗传编码荧光探针可时空分辨地进行代谢监测,是解决这一挑战的理想工具。研究团队在过去十余年开发了系列高性能细胞代谢荧光探针以及活细胞代谢监测技术:Nature Methods(2017)、Nature Metabolism(2023;2021)、Nature Protocols(2018;2016)、Cell Metabolism(2023;2015;2011)、Developmental Cell(2020),并应用这一前沿技术系统深入地研究了氧化还原代谢的白血病致病机制(Cell Metabolism(2019)、Blood(2020)、Science Advances(2021)、Cell Reports(2022)、PNAS(2023))。
氧化还原水平与白血病发生发展
低水平的活性氧对于白血病起始细胞存活和维持静息状态至关重要。利用自主研发的过氧化氢探针HyPerion和NADPH探针iNap,研究团队证明了低的H2O2水平和高的NADPH水平细胞亚群富含更多功能性的急性髓系白血病起始细胞,这些细胞倾向于定位于骨内膜微环境,移植后白血病发病更快,总生存时间更短。苹果酸酶以及亚甲基四氢叶酸脱氢酶对于这群细胞的白血病形成能力至关重要。除了急性髓系白血病,低的活性氧和高的还原力也与急性或慢性淋巴细胞白血病的发生发展密切相关。
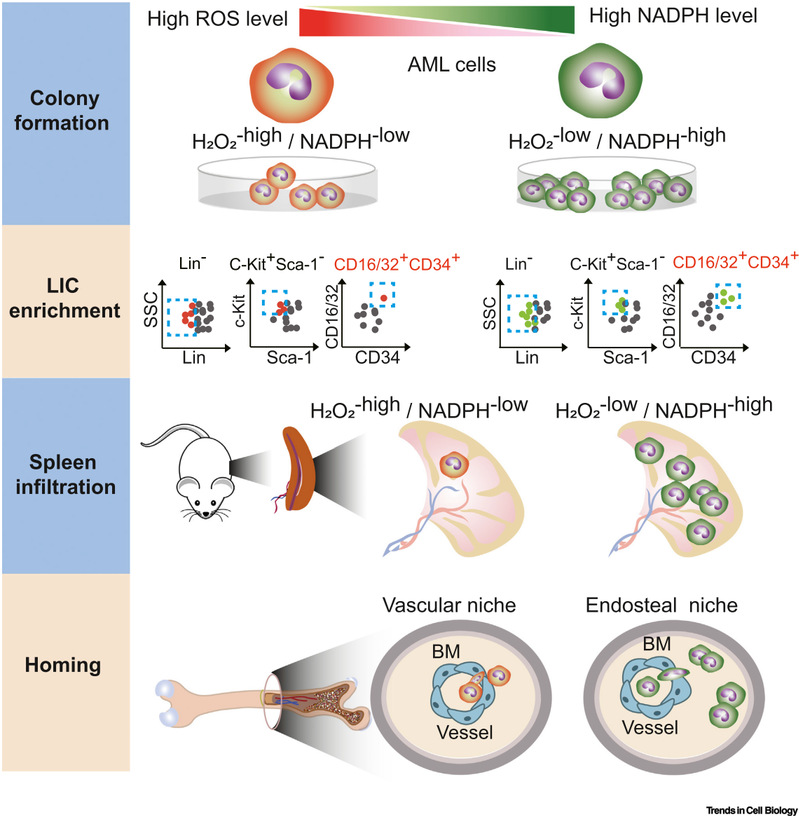
图1低的活性氧和高的还原力促进急性白血病的发生发展
细胞代谢编程与白血病发生发展
白血病细胞显示出能量和物质代谢的异质性。一般来说,氧化磷酸化对能量产生至关重要,在许多情况下是通过丙酮酸、脂肪酸、谷氨酰胺和支链氨基酸提供燃料。在急性髓系和淋巴细胞白血病中,抑制线粒体呼吸可解除对化疗药物如阿糖胞苷的抵抗,其中丙酮酸脱氢酶等是潜在的治疗靶标。除了氧化磷酸化,高的糖酵解活性也支持白血病发生发展。对于脂肪酸代谢,无论分解还是合成途径都驱动白血病的发生。此外,氨基酸和异柠檬酸代谢异常通过改变核苷酸与脂肪酸合成、表观遗传修饰等机制发挥了促进白血病发生的作用。这些代谢途径具有密切的联系,在白血病中,抑制葡萄糖氧化通常会代偿性地增加脂肪酸氧化,反之亦然。在葡萄糖/丙酮酸和脂肪酸之间选择底物不仅决定了能量生产的效率,而且还决定了活性氧的水平。
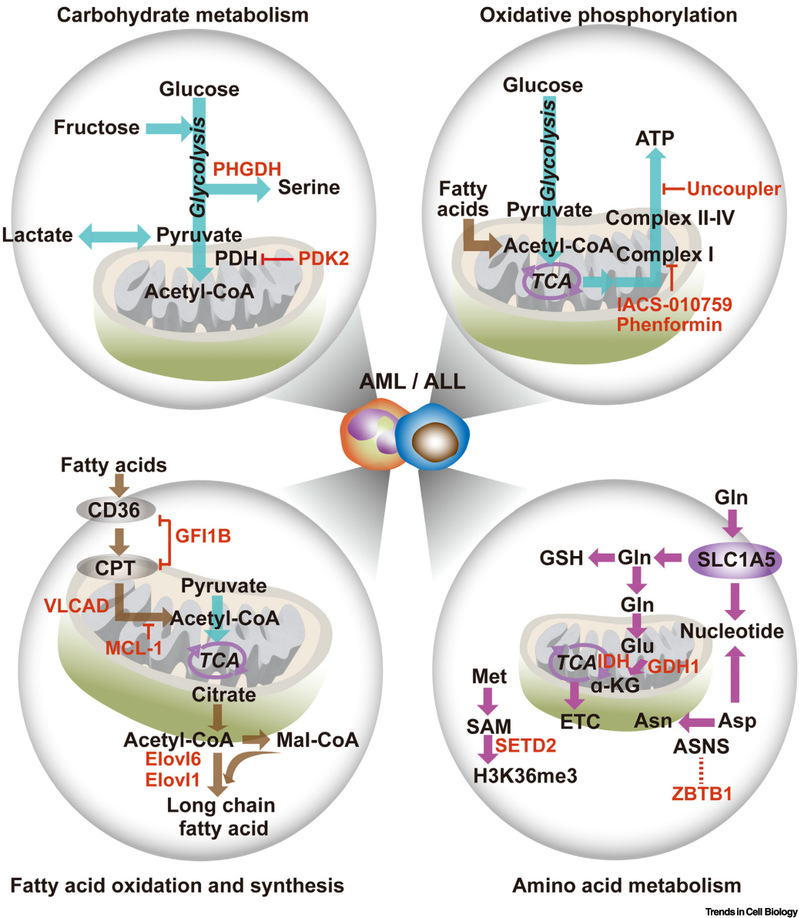
图2细胞代谢重编程驱动白血病发生发展
尽管关于白血病的代谢重编程的研究已经取得了重要进展,但由于细胞代谢、遗传变异、骨髓微环境的相互影响,致病机制展示出高度的复杂性,白血病的基础和转化研究仍然面临一些尚未解决的重要问题。文章指出了几个关键挑战,包括发展高质量的代谢物探针、集成代谢和免疫标志物精准识别白血病功能性细胞亚群、解析代谢促进白血病复发和药物抵抗的机制、以及克服代谢可塑性实现临床转化治疗的潜力。
我校张卓助理研究员、李写副研究员、上海交通大学医学院陈迟琪副研究员为本论文的第一作者。我校赵玉政教授和上海交通大学医学院郑俊克研究员为该论文共同通讯作者。研究工作得到国家重点研发计划、国家自然科学基金、上海市细胞代谢光遗传学技术前沿科学研究基地、中国医学科学院医学与健康科技创新工程、上海市科委等科研项目资助。
原文链接:
https://www.cell.com/trends/cell-biology/fulltext/S0962-8924(23)00205-2